Dr hab. inż. prof. nadzw. Dorota Lewińska - Kierownik Pracowni
Dr inż. Marcin Grzeczkowicz
Dr inż. Katarzyna Kramek-Romanowska
Mgr inż. Adam Mirek (doktorant)
Wszystkie opracowane przez Zespół metody enkapsulacji żywych komórek wykorzystują elektrostatyczny generator kropel pracujący w trybie impulsowym (impulsy o wysokim napięciu), który umożliwia wytwarzanie sferycznych, jednorodnych pod względem wielkości mikrokulek hydrożelowych o średnicy od 0,2 do 3,0 mm o bardzo małym rozrzucie średnic (współczynnik zmienności średniej średnicy VC poniżej 10%).
Elektrostatyczny generator kropel może pracować wyposażony w:
- pojedynczą dyszę (układ przeznaczony do mikroenkapsulacji niewielkich ilości komórek – np. szczurzych wysp Langerhansa)
- wielodyszową głowicę (układ przeznaczony do wytwarzania większych ilości mikrokulek)
- podwójną głowicę (przeznaczony do jednoetapowego wytwarzania mikrokapsułek np. z ciekłym rdzeniem PATENT RP Nr 208384)
Wszystkie wymienione typy urządzeń zostały przetestowane eksperymentalnie podczas enkapsulacji żywych komórek: drożdży piekarskich (Rys. 1), komórek linii WEHI-3B, linii komórkowych (hepatocyty) C3A i HepG2, szczurzych wysp Langerhansa oraz ludzkich przytarczyc (Rys. 2). Stwierdzono, że zastosowane pole elektrostatyczne jest bezpieczne dla enkapsulowanych komórek i nie powoduje uszkodzenia ich funkcji.
| Rys.1. | a) | 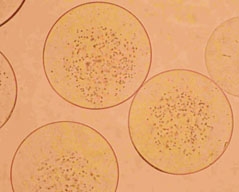 |
b) | 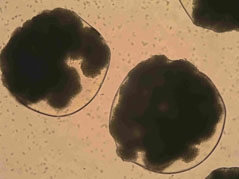 |
| Komórki drożdży piekarskich enkapsulowane wewnątrz sferycznych matryc alginianowych wytworzonych za pomocą głowicy podwójnej: | ||||
| a) bezpośrednio po wytworzeniu | b) po 48 godzinach hodowli | |||
| Lewińska et al. Biocybernetics and Biomedical Engineering, 2008, 28(2), 69-84 | ||||
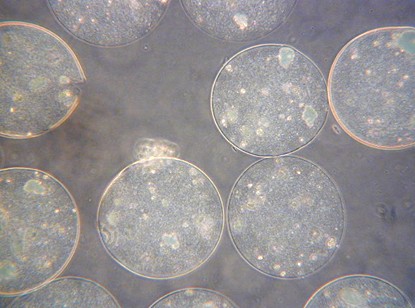
Rys. 2. Immobilizowane wewnątrz mikrosfer alginianowych komórki ludzkich przytarczyc.
- głowica 3-dyszowa (PATENT RP Nr 208383)
Stosując opracowaną w Zespole, specjalną głowicę trójdyszową można w procesie jednoetapowym wytworzyć nowe, unikatowe mikrokapsułki mieszane: alginianowo-polieterosulfonowe. Składają się one z biokompatybilego, hydrożelowego rdzenia zawierającego komórki, otoczonego półprzepuszczalną membraną wytworzoną z wysokocząsteczkowego polimeru syntetycznego. Ten rodzaj mikrokapsułek (Rys. 3-5) może być szeroko stosowany w medycynie, farmacji oraz biotechnologii z uwagi na ich zwiększoną w stosunku do klasycznych mikrokapsułek APA (alginianowo-polilizynowo-alginianowych) wytrzymałość mechaniczną, odporność chemiczną oraz polepszone właściwości transportu masy.

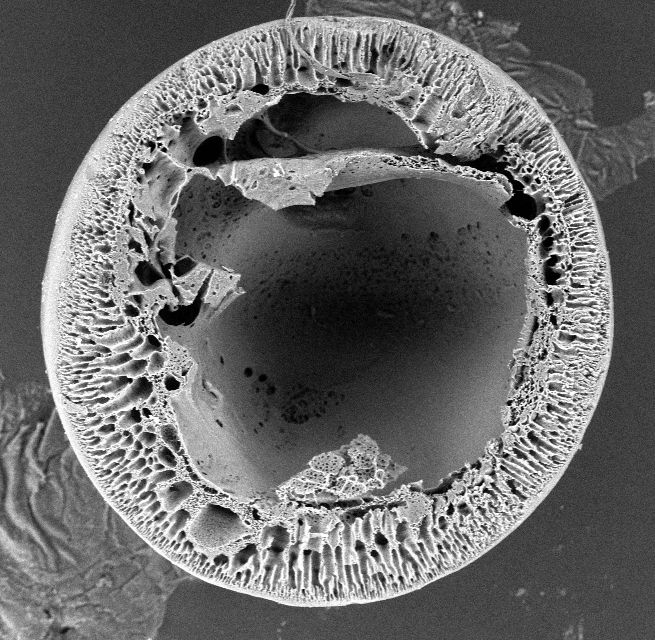
Rys. 3. Wygląd mikrokapsułek alginianowo-polieterosulfonowych (AP). Rys. 4. Obraz wnętrza mikrokapsułki AP spod mikroskopu elektronowego.
a) 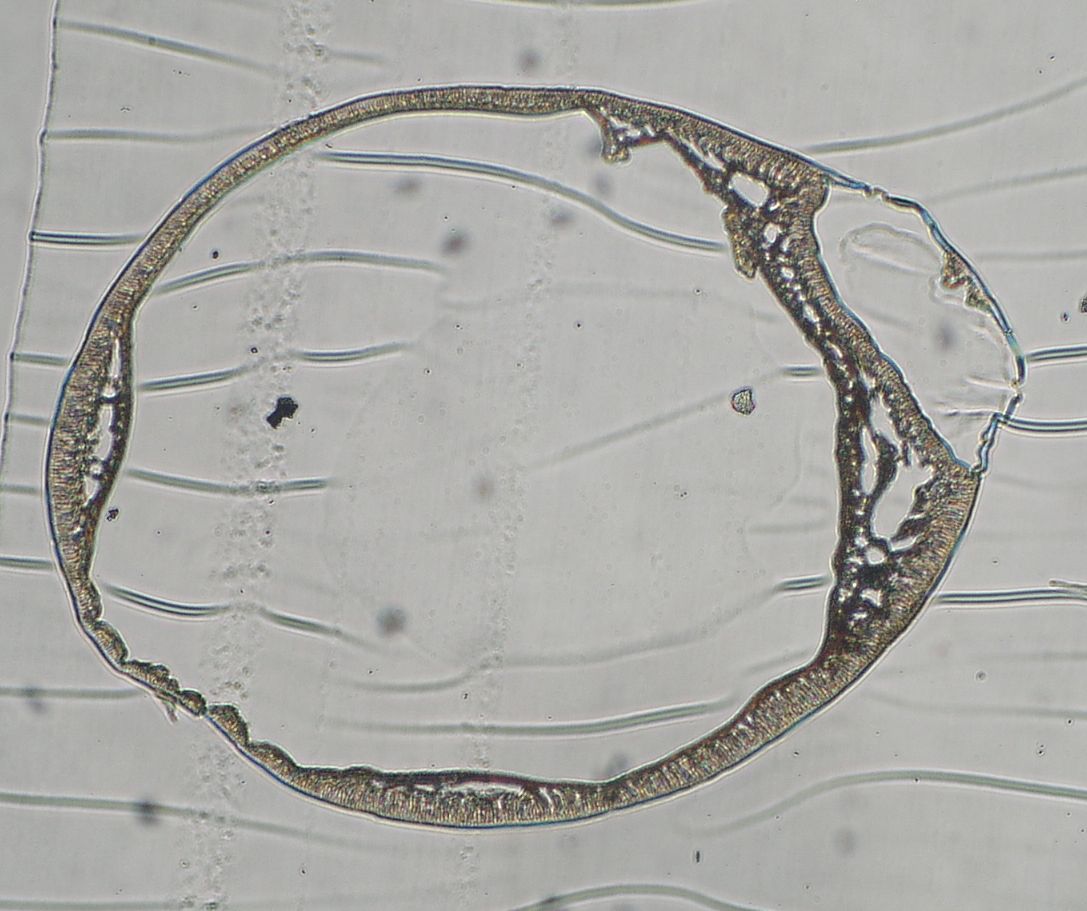 b)
b) 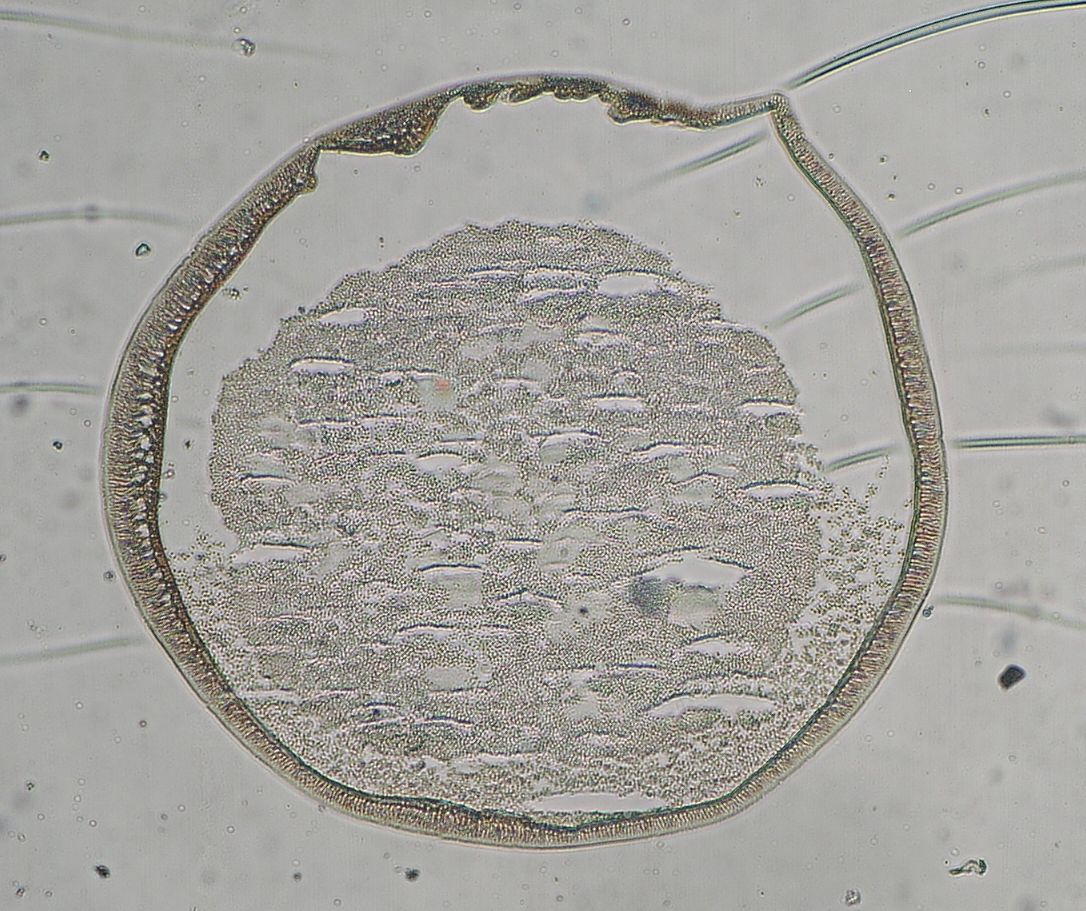
Fig.5. Wygląd spod mikroskopu optycznego wnętrza mikrokapsułek AP zawierających enkapsulowane drożdże piekarskie: (a) przed i (b) po 24 godz. hodowli.
Jak pokazano, proces mikroenkapsulacj z użyciem głowicy trójdyszowej nie niszczy komórek, które zachowały zdolność do namnażania się, a zastosowana membrana polieterosulfonowa jest przepuszczalna dla substancji odżywczych.
Słowa kluczowe: mikroenkapsulacja komórek, pole elektrostatyczne, mikrokapsułki z ciekłym wnętrzem, mikrokapsułki alginianowo-polieterosulfonowe, kulki alginianowe.
Wybrane publikacje:
- Lewińska D, Rosiński S, Weryński A: Influence of process conditions during impulsed electrostatic droplet formation on size distribution of hydrogel beads; Artif Cell, Blood Substitutes and Biotechnol, vol. 32, 1, 41-53, 2002
- Lewińska D, Rosiński S, Hunkeler D, Poncelet D, Weryński A: Mass transfer coefficient in characterization of gel beads and microcapsules, J. Membrane Sci, vol. 209(2): 533-540, 2002
- Rosiński S, Lewińska D, Migaj M, Woźniewicz B, Weryński A: Electrostatic microencapsulation of parathyroid cells as a tool for the investigation of cells activity after transplantation”; Landbauforschung Voelkenrode, Special Issue, 241, 47-50, 2002
- Hunkeler D, Wandrey Ch, Rosiński S, Lewińska D, Weryński A: Characterization of microcapsules (in: Fundamentals of Cell Immobilisation Biotechnology, eds. Nedovič V, Willaert R), Kluwer Academic Publishers, Dordrecht, Boston, London, 8A, 389-410, 2004
- Rosiński S, Lewińska D, Wójcik M, Orive G, Pedraz JL, Weryński A: Mass transfer characteristics of poly-lysine, poly-ornithine and poly-methylene-co-guanidine membrane coated alginate microcapsules. J Membrane Sci, vol. 254, 249-257, 2005
- Kinasiewicz A, Gautier A, Lewińska D, Bukowski J, Legallais C, Weryński A: Culture of C3A cells in alginate beads for fluidized bed bioartificial liver. Transplant Proc, vol. 39(9) 2911-13, 2007
- Lewińska D, Bukowski J, Kożuchowski M, Kinasiewicz A, Weryński A: Electrostatic microencapsulation of living cells. Biocyb and Biomed Eng, vol. 28(2), 69-84, 2008
- Prusse U, Bilancetti L, Bucko M, Bugarski B, Bukowski B, Gemainer P, Lewińska D, Massart B, Nastruzzi C, Nedovic V, Poncelet D, Siebenhaar S, Tobler L, Tosi A, Vikartovska A, Vorlop K-D: Comparison of different technologies for alginate bead production. Chem Papers, vol. 62(4), 364-374, 2008
- Kinasiewicz A, Gautier A, Lewińska D, Śmietanka A, Legallaise C, Weryński A: Three-dimensional growth of human hepatoma C3A cells within alginate beads for fluidized bioartificial liver. Int J Artif Organs, vol. 31(4), 340-347, 2008
- Kupikowska B, Lewińska D, Dudziński K, Jankowska-Śliwińska J, Grzeczkowicz M, Wojciechowski C: The influence of changes in composition of membrane-forming solution on the structure of alginate-polyethersulfone microcapsules. Biocyb and Biomed Eng, vol. 29(3), 61-69, 2009
- Lewińska D, Chwojnowski A, Wojciechowski C, Kupikowska-Stobba B, Grzeczkowicz M, Weryński A: Electrostatic droplet generator with 3-coaxial-nozzle head for microencapsulation of living cells in hydrogel covered by synthetic polymer membranes. Sep Sci and Technol, vol. 47(3), 463-469, 2012
- Chwojnowski A, Wojciechowski C, Lewińska D, Łukowska E, Nowak J, Kupikowska-Stobba B, Grzeczkowicz M.: Studies on the structure of semi-permeable membranes by means of SEM. Problems and potential sources of errors. Biocybernetics and Biomedical Engineering, vol. 32(1), 51-64, 2012
- Kupikowska-Stobba B, Lewińska D, Grzeczkowicz M: Chemical method for retrieval of cells encapsulated in alginate-polyethersulfone microcapsules: Artif Cells Nanomed and Biotechno, vol. 42(3), 151-160, 2014, DOI:10.3109/21691401.2013.800083
- Przytulska M, Kulikowski J.L., Lewińska D, Grzeczkowicz, Kupikowska-Stobba B: Computer-Aided Image Analysis for Microcapsules’ Quality Assessment. Biocyb and Biomed Eng, vol. 35(4), 342-350, 2015, DOI:10.1016/j.bbe.2015.05.005
- Lewińska D, Grzeczkowicz M, Kupikowska-Stobba B: Influence of electric parameters on the alginate-polyethersulfone microcapsule structure. Desalination and Water Treatment vol. 64, 400-408, 2017 DOI: 10.5004/dwt.2017.11407. 64 (2017)
- Korycka, P., Mirek, A., Kramek-Romanowska, K., Grzeczkowicz, M., Lewińska, D., Effect of electrospinning process variables on the size of polymer fibers and bead-on-string structures established with a 23 factorial design. Beilstein J. Nanotechnol. 9, 2466–24780, 2018, DOI:10.3762/bjnano.9.2312466–2478
Patenty:
Lewińska D, Bukowski J, Rosiński S, Kożuchowski M, Weryński A: ”Sposób jednoetapowego wytwarzania mikrokapsułek, zwłaszcza zawierających żywe komórki, ich zbiory lub substancje biologicznie aktywne, oraz urządzenie do ich wytwarzania”, PATENT RP Nr 208384, 2004
Lewińska D, Chwojnowski A, Jankowska-Śliwińska J, Weryński A: „Mikrokapsułki zawierające substancje biologicznie aktywne, zwłaszcza żywe komórki i/lub mikroorganizmy, ewentualnie genetycznie modyfikowane, albo naturalne lub syntetyczne do zastosowań biomedycznych, sposób ich wytwarzania oraz urządzenie do stosowania tego sposobu”, . PATENT RP Nr 208383, 2007
Lewińska D, Kupikowska-Stobba B, Grzeczkowicz M, Chwojnowski A, Łukowska E: „Sposób oznaczania stężenia komórek.” PATENT RP Nr 223717, 2012
Zgłoszenia patentowe:
Chwojnowski A, Łukowska E, Wojciechowski C, Lewińska D: “Membrana półprzepuszczalna i sposób jej otrzymywania.” Nr P.403657 z dnia 24.04.2013
Kutkowska A, Lewińska D, Grzeczkowicz M, Chwojnowski A: „Urządzenie do formowania sferycznych membran polimerowych w układach wolno żelujących.” Nr P.417705 z dnia 23.06.2016
Współpraca międzynarodowa:
W latach 1999-2004 w ramach Europejskiego Projektu Akcja COST 840 “Bioencapsulation. Innovations and Technologies.” bezpośrednia współpraca z naukowcami z następujących jednostek naukowo-badawczych:
Institute of Technology and Biosystems Engineering Federal Agricultural Research Centre (FAL) obecnie: Thüne Insitute of Agricultural Technology, Brunszwik, Niemcy;
Institute of Chemistry Slovak Academy of Sciences, Bratysława, Słowacja;
Deptartment of Chemical Engineering Faculty of Technology and Metallurgy, Belgrad Serbia i Czarnogóra;
ENITIAA, UMR CNRS GEPEA, Nantes, Francja;
Laboratory of Polyelectrolytes and Biomacromolecules, Swiss Federal Institute of Technology, Lozanna, Szwajcaria;
Institute of Pharmaceutical Technology and Biopharmaceutics, University of Vienna, Austria;
School of Chemical Engineering, University of Birmingham, Edgbaston, Birmingham, Wielka Brytania;
Laboratory of Chemical and Biological Engineering, Swiss Federal Institute of Technology, Lozanna, Szwajcaria;
Department of Pharmacy and Pharmaceutical Technology, University of Basque Country, Vitoria, Hiszpania.
W latach 2005-2007, w ramach dwustronnego projektu Polonium, współpraca z grupą prof. Cecile Legallais z University of Technology, Compiegne, CNRS, UMR 6600, Compiegne Francja w temacie: „Modification of alginate beads with hepatocytes for bioartificial liver.”
Granty:
- Specjalna dotacja KBN SPUB-M Nr 56/E-83/ SPUB/COST/P-04/DZ 62/99 pt.: „Akcja COST 840 – Dobór warunków procesu wywarzania mikrokapsułek przy pomocy pola elektrostatycznego oraz opłaszczania mikrokapsułek membraną i opracowanie metody badania ich własności transportowych in vitro” - lata 1998-2001
- Projekt badawczy PB 538/PO5/98/15 pt.: ”Nowa strategia terapeutyczna w transplantologii. Allotransplantacja komórek przytarczyc ludzkich in vitro w leczeniu niedoczynności przytarczyc bez immunosupresji” - lata 1998-2001
- Specjalna dotacja KBN SPUB-M Nr 56/E-83/ SPUB/COST/P-04/DZ584/2002-2003 pt.: „Opracowanie i zbadanie zmodyfikowanego elektrostatycznego generatora mikrokapsułek. Wykonanie badań transportowych mikrokapsułek wytwarzanych w ramach projektu COST 840” lata 2002-2004
- Projekt badawczy własny Nr N N518 415136 pt.: ”Opracowanie sposobu wytwarzania jednorodnych membran polimerowych w nowych mikrokapsułkach alginianowo-polieterosulfonowych z wykorzystaniem metod i algorytmów komputerowej analizy obrazów.”- lata 2009-2011.




















